Contexte historique et réglementaire de la publicité pour les dispositifs médicaux
Dates clés influençant la réglementation des dispositifs médicaux .
La publicité pour les dispositifs médicaux (DM) et les dispositifs médicaux de diagnostic in vitro (DMDIV) est soumise à une réglementation européenne stricte. Cette réglementation a évolué au fil du temps :
- En 1985, les Résolutions du Conseil ont harmonisé la réglementation technique et la libre-circulation pour les DM.
- Entre 1990 et 1998, trois Directives européennes ont été publiées avec des exigences sur la sécurité et la performance pour la santé.
- La révision générale de 2007 a renforcé l’évaluation clinique des DM.
- En 2017, les Règlements pour les dispositifs médicaux ont amélioré le niveau de protection de la santé publique et évité les divergences réglementaires.
Le scandale des prothèses PIP
Le scandale des prothèses PIP a accru les exigences pour la publicité des DM. Les publicités ne doivent pas induire le patient en erreur ou suggérer des utilisations non déclarées, et doivent inclure les risques liés à l’utilisation. La réglementation actuelle est claire pour éviter une impression trompeuse sur le traitement, le diagnostic, les fonctions et propriétés du dispositif.
Quelle est la réglementation actuelle en matière de publicité pour les dispositifs médicaux en Europe et comment a-t-elle évolué au fil du temps ?
Quelques définitions sur la Publicité des dispositifs médicaux
Les textes réglementaires
La publicité pour les DM et les DMDIV se définie comme toute forme d’information visant à promouvoir leur prescription, vente ou utilisation. L’article premier du règlement (UE) 2017/745 définit les règles pour la publicité des DM tandis que les articles L5213-1 et L5223-1 du Code de la Santé Publique les énoncent pour les DMDIV. Toutefois, la publicité dispensée par les pharmaciens est exclue.
Si la promotion pour des DM non marqués CE est diffusée auprès du grand public, elle doit inclure la mention « Ce dispositif médical est un produit de santé réglementé qui porte, au titre de cette réglementation, le marquage CE ». En général, ce genre de promotion n’est pas autorisé.
Comprendre le champ d’application de la publicité pour les dispositifs médicaux
Le champ de la publicité exclut l’étiquetage, la notice d’instruction, les réponses à des questions précises, les catalogues sans allégations. Il exclut également les fiches techniques, les informations de sécurité, et les informations relatives à la santé humaine ou aux maladies humaines.
Quelles sont les règles établies par l’ANSM pour la publicité des dispositifs médicaux (DM) et des dispositifs médicaux de diagnostic in vitro (DMDIV) ?
Les grandes règles de la Publicité des dispositifs médicaux
Les directives de l’ANSM sur la publicité des dispositifs médicaux
L’ANSM a établi des règles pour la publicité des DM et des DMDIV. La publicité doit être objective, exacte, à jour, vérifiable et en français. Elle ne doit pas être trompeuse, ne présenter aucun risque pour la santé publique et mentionner la position. Toute allégation doit pouvoir être justifiée. Il y a des interdictions pour certains éléments, comme les photos avec des sourires exagérés et le vocabulaire trompeur. De plus, L’ANSM souhaite faire un contrôle de la communication promotionnelle avant l’utilisation de certains dispositifs qui présentent un risque important. Les DM et DMDIV concernés sont listés dans l’arrêté du 24 septembre 2012.
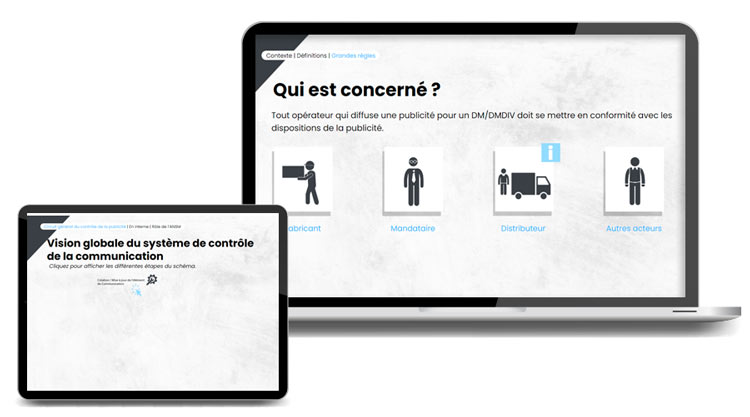
Les acteurs de la publicité des DM
Selon la Charte de qualité des pratiques professionnelles encadrant la promotion des DM/DMDIV, les opérateurs concernés sont les personnes en charge de l’activité de promotion, de présentation ou d’information des exploitants** et distributeurs au détails des produits. Tout opérateur doit respecter les dispositions de la publicité, incluant le fabricant, le mandataire, le distributeur et toutes les personnes impliquées dans la fabrication, la distribution ou l’importation.
Règlementation de la publicité pour les produits de santé selon la cible
Les articles concernant les spécificités en fonction de la cible incluent :
- Grand public : Il est possible de faire de la publicité pour les DM et DMDIV auprès du grand public pour certains types de produits, mais il est interdit pour d’autres. La publicité ne doit pas mentionner les prises en charge par les assurances maladies et doit inclure des mentions obligatoires.
- Professionnels de santé*** : La publicité destinée aux professionnels de santé fera l’objet de contrôles pour certains produits selon une liste déterminée par l’ANSM.
Pour résumer …
La publicité pour les dispositifs médicaux est soumise à une réglementation stricte en Europe. Elle a évolué au fil du temps, depuis les résolutions du Conseil de 1985 jusqu’aux règlements de 2017 pour les dispositifs médicaux. Le scandale des prothèses PIP a augmenté les exigences pour la publicité pour les DM.
La publicité pour les DM et les DMDIV est définie comme toutes les informations visant à les promouvoir. Elle exclut celle dispensée par les pharmaciens et doit suivre les règles mentionnées dans le règlement de 2017 et le Code de la Santé Publique. La promotion pour des DM non marqués CE n’est pas autorisée et doit inclure une mention spécifique si diffusée auprès du grand public.
L’ANSM établit les règles pour la publicité des DM et DMDIV. La publicité doit être objective, exacte, vérifiable, et ne pas être trompeuse ou présenter des risques pour la santé publique. Toutes les allégations doivent pouvoir être prouvées et les publicités ne doivent pas inclure des informations exclues.
Programme de la formation en ligne La publicité des dispositifs médicaux – elearning
* ANSM : Agence Nationale de Sécurité du Médicament et des Produits de santé
** L’exploitant d’un DM est le fabricant, le mandataire de ce dernier ou le distributeur assurant l’exploitation d’un DM : l’exploitation comprend la commercialisation ou la cession à titre gratuit sur le territoire français.
*** Personne qui a l’autorité de prescrire, d’acheter et d’utiliser des médicaments et des dispositifs médicaux dans le cadre de son métier, incluant les ingénieurs, les radiophysiciens, les pompiers, les directeurs d’hôpitaux, les associations de patients, etc.

Eric Villemagne, Directeur Général chez IFIS Interactive depuis plus de 10 ans, incarne avec excellence l’expertise et l’innovation dans le domaine de la formation e-learning pour les industries de santé. Fort d’une ancienneté de plus de 20 ans au sein du groupe IFIS et d’une expérience enrichissante de 25 ans dans le secteur de la formation, sa carrière est marquée par une contribution significative à l’évolution et à l’amélioration des processus d’apprentissage. Diplômé d’un Executive MBA de l’EM Lyon, Eric s’engage avec détermination à fournir des formations sur étagère et sur mesure, répondant précisément aux besoins des professionnels de l’industrie pharmaceutique, du dispositif médical et de la cosmétique.
Sa vision stratégique ne s’arrête pas là. Eric ambitionne de contribuer activement à la relocalisation et au développement durable de ces industries cruciales en France et en Europe. Par ce biais, il affirme non seulement son leadership mais également son engagement indéfectible envers l’excellence éducative et industrielle. Sa démarche vise à instaurer un environnement propice à l’innovation et à la croissance durable, en mettant l’accent sur des solutions de formation qui anticipent et répondent aux défis de demain.