Les essais cliniques de dispositifs médicaux sont des études menées pour évaluer l’efficacité et la sécurité de nouveaux dispositifs médicaux. Ce guide vous explique les différentes phases des essais cliniques, les critères d’inclusion et d’exclusion, ainsi que les risques et les avantages potentiels pour les participants.
Qu’est-ce qu’un essai clinique de dispositif médical ?
Un essai clinique de dispositif médical est une étude menée pour évaluer l’efficacité et la sécurité d’un nouveau dispositif médical. Ces essais sont généralement menés en plusieurs phases, et les participants sont sélectionnés selon des critères d’inclusion et d’exclusion stricts. Il est donc essentiel que les participants répondent à ces critères pour assurer la validité des résultats de l’étude. De plus, il est important de souligner que les essais cliniques de dispositifs médicaux sont indispensables pour garantir la sécurité et l’efficacité des nouveaux dispositifs avant leur mise sur le marché.
Les différentes phases des essais cliniques pour tester un dispositif médical
Les essais cliniques de dispositifs médicaux sont généralement menés en plusieurs phases.
- Les essais cliniques phase 1 sont généralement des petites études de sécurité qui implique un petit nombre de participants en bonne santé.
- Les essais cliniques phase 2 sont des études plus importante qui implique des participants atteints de la maladie ou de la condition pour laquelle les dispositifs sont destinés.
- Les essais cliniques phase 3 sont des études encore plus importante qui implique un plus grand nombre de participants et qui est conçue pour évaluer l’efficacité et la sécurité du dispositif.
- Enfin,
- Les essais cliniques phase 4 sont des étude post-commercialisation qui est menée après que le dispositif a été approuvé pour une utilisation plus large.
Qui participe aux essais cliniques de dispositifs médicaux ?
Les participants aux essais cliniques de dispositifs médicaux peuvent être des personnes en bonne santé ou des personnes atteintes de la maladie ou de la condition pour laquelle le dispositif est destiné. Toutefois, les critères d’inclusion et d’exclusion sont déterminés par les chercheurs pour s’assurer que les participants répondent aux exigences de l’étude. Ainsi, les participants peuvent être recrutés par le biais de publicités, de médecins ou d’autres professionnels de la santé, ou encore de groupes de soutien pour les personnes atteintes de la maladie ou de la condition en question. En outre, il est important de noter que les participants doivent donner leur consentement éclairé avant de participer à l’étude.
Les risques et les avantages des essais cliniques des dispositifs médicaux
Les essais cliniques de dispositifs médicaux comportent des risques et des avantages potentiels pour les participants.
Les risques
Les risques peuvent inclure des effets secondaires indésirables, des complications médicales ou des résultats imprévus.
Les avantages
Les avantages peuvent inclure l’accès à un traitement potentiellement bénéfique, une surveillance médicale étroite et la possibilité de contribuer à la recherche médicale.
Il est important que les participants comprennent les risques et les avantages potentiels avant de décider de participer à un essai clinique.
Comment trouver des essais cliniques de dispositifs médicaux ?
Il existe plusieurs façons de trouver des essais cliniques de dispositifs médicaux. Vous pouvez consulter des sites web spécialisés tels que ClinicalTrials.gov, qui répertorie les essais cliniques en cours dans le monde entier. Vous pouvez également contacter des centres de recherche médicale ou des hôpitaux pour savoir s’ils mènent des essais cliniques de dispositifs médicaux. Enfin, votre médecin traitant peut également être en mesure de vous orienter vers des essais cliniques pertinents pour votre état de santé. Il est important de discuter avec votre médecin de toute décision de participer à un essai clinique.
Pour résumer …
Les essais cliniques de dispositifs médicaux sont des études essentielles pour évaluer l’efficacité et la sécurité des nouveaux dispositifs avant leur mise sur le marché. Ils sont menés en plusieurs phases avec des critères stricts d’inclusion et d’exclusion pour les participants. Les participants peuvent être des personnes atteintes de la maladie ou de la condition pour laquelle le dispositif est destiné ou des personnes en bonne santé. Les risques et les avantages potentiels doivent être compris avant de décider de participer à un essai clinique, et il existe plusieurs façons de trouver des essais cliniques de dispositifs médicaux. Il est important de discuter avec votre médecin de toute décision de participer à un essai clinique.
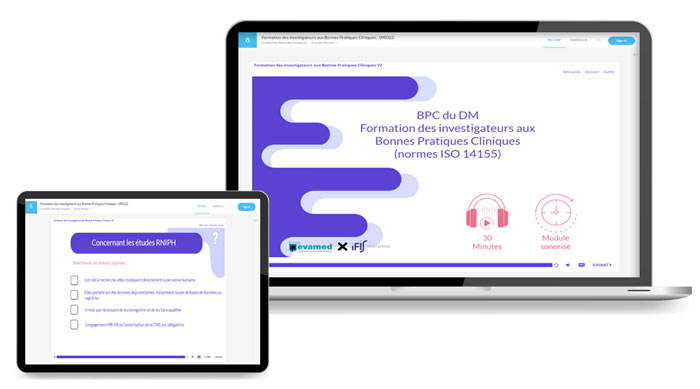
Programme de la formation sur Les Bonnes Pratiques Cliniques BPC du Dispositif Médical – Formation en ligne elearning
La formation en ligne « Les BPC du Dispositif Médical » en format elearning est entièrement dédiée à la Norme ISO14155 : les bonnes pratiques cliniques, leurs responsabilités, leurs enjeux et leurs différents process lors d’investigations cliniques de dispositifs médicaux.
Un format 100 % immersif avec des contenus interactifs. Pour s’imprégner au mieux des missions de chacun au cours d’un essai clinique de dispositif médical.
* ANSM : Agence Nationale de Sécurité du Médicament et des Produits de santé
** L’exploitant d’un DM est le fabricant, le mandataire de ce dernier ou le distributeur assurant l’exploitation d’un DM : l’exploitation comprend la commercialisation ou la cession à titre gratuit sur le territoire français.
*** Personne qui a l’autorité de prescrire, d’acheter et d’utiliser des médicaments et des dispositifs médicaux dans le cadre de son métier, incluant les ingénieurs, les radiophysiciens, les pompiers, les directeurs d’hôpitaux, les associations de patients, etc.

Eric Villemagne, Directeur Général chez IFIS Interactive depuis plus de 10 ans, incarne avec excellence l’expertise et l’innovation dans le domaine de la formation e-learning pour les industries de santé. Fort d’une ancienneté de plus de 20 ans au sein du groupe IFIS et d’une expérience enrichissante de 25 ans dans le secteur de la formation, sa carrière est marquée par une contribution significative à l’évolution et à l’amélioration des processus d’apprentissage. Diplômé d’un Executive MBA de l’EM Lyon, Eric s’engage avec détermination à fournir des formations sur étagère et sur mesure, répondant précisément aux besoins des professionnels de l’industrie pharmaceutique, du dispositif médical et de la cosmétique.
Sa vision stratégique ne s’arrête pas là. Eric ambitionne de contribuer activement à la relocalisation et au développement durable de ces industries cruciales en France et en Europe. Par ce biais, il affirme non seulement son leadership mais également son engagement indéfectible envers l’excellence éducative et industrielle. Sa démarche vise à instaurer un environnement propice à l’innovation et à la croissance durable, en mettant l’accent sur des solutions de formation qui anticipent et répondent aux défis de demain.